Die im Folgenden aufgelisteten Inhalte stellen ein Beispiel (Maximalkatalog) dar, aus dem Schwerpunkte gebildet werden sollten.
Gewinnung, Speicherung und Nutzung elektrischer Energie
1. Galvanische Elemente und Spannungsreihe:
2. Konzentrationsketten und Nernst-Gleichung:
3. Elektrochemische Energiequellen:
4. Elektrolysen:
5. Korrosion und Korrosionsschutz:
Zum Thema Korrosion lassen sich in Verbindung mit Referaten auch gut die Folien des Fonds der Chemischen Industrie einsetzen.
6. Literatur:
(zurück)
Geräte und Chemikalien:
U-Rohr mit Glasfritte als halbdurchlässige Trennwand
(Diaphragma) oder zwei kleine Bechergläser mit Salzbrücke (ein Streifen Filtrierpapier, das mit
Kaliumnitratlösung getränkt wurde), ideal wären auch entsprechende Teile
aus im Lehrmittelhandel angebotenen Elektrochemiebaukästen,
Spannungsmessgerät (hochohmiger Eingang) mit 2 passenden Kabeln,
Metallelektroden (Blech, Stab oder Draht) mit sauberer Oberfläche: Zink Eisen,
Kupfer, Silber
Metallsalzlösungen (alle c = 0,1 mol/L): Zinksulfat, Eisen-II-sulfat oder
Ammoniumeisen-II-sulfat, Kupfersulfat, Silbernitrat
Versuchsdurchführung:
Die beiden Halbzellen (U-Rohr oder Bechergläser) werden mit zwei unterschiedlichen Metallsalzlösungen gefüllt. In die Lösungen werden die entsprechenden Metalle eingetaucht (z.B. Zink in Zinksulfatlösung). Die beiden Elektroden werden mit dem Spannungsmessgerät verbunden. Die Spannung wird gemessen. Außerdem wird festgehalten, welche Metallelektrode den Plus- bzw. Minuspol hat. Der Versuch ist mit allen Metall/Metallsalzkombinationen durchzuführen.
Auswertung:
Es wird eine Ordnung der Metall/Metallsalzsysteme entsprechend der zwischen den Systemen gemessenen Spannungen entwickelt.
Beispiel:
Zn/Zn2+ // Fe/Fe2+
U = 0,3 V
Fe/Fe2+ // Cu/Cu2+ U = 0,8 V
Zn/Zn2+ // Cu/Cu2+ U = 1,1 V
Fe/Fe2+ // Ag/Ag+ U
= 1,2 V
Zn/Zn2+ // Ag/Ag+ U
= 1,6 V
Cu/Cu2+ // Ag/Ag+ U
= 0,4 V
Der Minuspol befindet sich jeweils auf der linken Seite.
Hieraus ergibt sich unter Berücksichtigung der Beträge der
Spannung und Polung folgende Reihung:
Zn/Zn2+ Fe/Fe2+ Cu/Cu2+ Ag/Ag+
Chemische Reaktion am Beispiel des Zn/Cu-Elements (Daniell-Element):
Oxidation: Zn -> Zn2+ + 2 e-
Reduktion: Cu2+ + 2 e- -> Cu
Redoxreaktion: Zn + Cu2+ -> Zn2+ +
Cu
Elektrische Energie des Zn/Cu-Elements:
Wel = n * F * U
n: Menge der umgesetzten Elektronen in mol
F: Faradaykonstante (96490 C/mol)
U: Spannung
Wel (Zn/Cu) = 2 mol * 96490 C/mol * 1,1 V = -212 kJ/mol
(zurück)
Halogenelektroden können durch Elektrolyse einer Kaliumhalogenidlösung an einer Graphitelektrode hergestellt werden (Halbzelle mit Pluspol). Die andere über eine Salzbrücke oder ein Diaphragma getrennte Halbzelle wird dabei mit Salzsäure gefüllt, in die ebenfalls eine Graphitelektrode (oder besser Platinelektrode) taucht. Diese wird als Minuspol geschaltet, wobei dann an dieser bei der Elektrolyse eine Wasserstoffelektrode hergestellt wird. Nach einer kurzen Elektrolysezeit (angelegte Spannung etwa 3 bis 4 Volt) wird dann die Stromquelle abgeklemmt und die Spannung zwischen beiden Halbzellen gemessen.
Konzentration aller Lösungen (Salzsäure, Kaliumchlorid, Kaliumbromid, Kaliumiodid): c=0,1 mol/l
Beipiele:
H2 / 2 H+ // Cl2 / 2 Cl-
U = 1,3 V
H2 / 2 H+ // Br2 / 2 Br-
U = 1,0 V
H2 / 2 H+ // I2 / 2 I-
U = 0,5 V
Der Minuspol befindet sich jeweils an der linken Seite.
Chemische Reaktion am Beispiel des Systems Wasserstoff/Chlor (Chlorelektrode):
Oxidation: H2 -> 2 H+ +
2 e-
Reduktion: Cl2 + 2 e- -> 2 Cl-
Redoxreaktion: H2 + Cl2 -> 2 H+
+ 2 Cl-
Es entsteht also im Prinzip aus den Elementen Chlor und Wasserstoff
Salzsäure. Diese Reaktion ist vergleichbar mit der Chlor-Knallgasreaktion.
(zurück)
Ionenprodukt von Wasser
Es wird folgende Zelle aufgebaut:
Pt1 / Pt2(H2) / H2SO4 (0,5 mol/L) //Salzbrücke// NaOH (x mol/L) / Pt3(H2) / Pt4
Zur Erzeugung der Wasserstoffelektroden in den beiden Halbzellen
(an den Platinelektroden Pt2 und Pt3) wird eine kurze
Elektrolyse vorgeschaltet. Hierzu werden die Elektroden Pt1 und Pt4
mit dem Pluspol und die Elektroden Pt2 und Pt3 mit
dem Minuspol einer Stromquelle verbunden (Elektrolysespannung 3 - 4 V).
Nach Abklemmen der Stromquelle wird die Zellspannung zwischen den Elektroden Pt2
und Pt3 gemessen.
Der Versuch wird für drei unterschiedliche Konzentrationen der Natronlauge in
der rechten Halbzelle durchgeführt.
Im Grunde liegt eine Wasserstoffionen-Konzentrationskette vor.
Über die Zellspannung lässt sich die Konzentration der Wasserstoffionen in der
Natronlauge berechnen.
Beispiel:
| c(OH-) mol/L | U V | c(H+) mol/L | Ionenprodukt KW |
| 10-1 | -0,720 | 10-12,2 | 10-13,2 |
| 10-2 | - 0,666 | 10-11,3 | 10-13,3 |
| 10-3 | - 0,620 | 10-10,5 | 10-13,5 |
Berechnung:
U = E1 - E2
E1 kann mit null angesetzt werden, weil die Konzentration
der Wasserstoffionen in der Schwefelsäure 1 mol/L beträgt und damit annähernd
eine Normalwasserstoffelektrode vorliegt.
E2 = 0,059 V * lg c(H+) = U
c(H+) = 10U/0,059V
KW = c(H+) * c(OH-)
(zurück)
Beispiel Silberchloridelektrode: Ag / AgCl / KCl-Lösung (c=1 mol/L)//
Diese lässt sich herstellen, indem man ein kleines Becherglas oder Reagenzglas mit der Kaliumchloridlösung füllt, einige Tropfen Silbernitratlösung hinzugibt (Bildung von Silberchlorid) und in die Lösung einen Silberdraht taucht. Über eine Salzbrücke (mit Kaliumnitratlösung getränktes Filtrierpapier) lässt sich diese Halbzelle mit einer beliebigen anderen Halbzelle kombinieren.
Die Konzentration der Silberionen ergibt sich aus dem Löslichkeitsprodukt:
KL (AgCL) = c (Ag+) * c (Cl-) = 10-9,75 (mol/L)2
Die Konzentration der Silberionen beträgt demnach c (Ag+) = 10-9,75 mol/L , da die Konzentration der Chloridionen 1 mol/L beträgt.
Potential der Halbzelle:
E (Ag+) = Eo (Ag+) + 0,059 V * lg c (Ag+)
E (Ag+) = 0,799V + 0,059 V * lg 10-9,75
E (Ag+) = 0,22 V
(zurück)
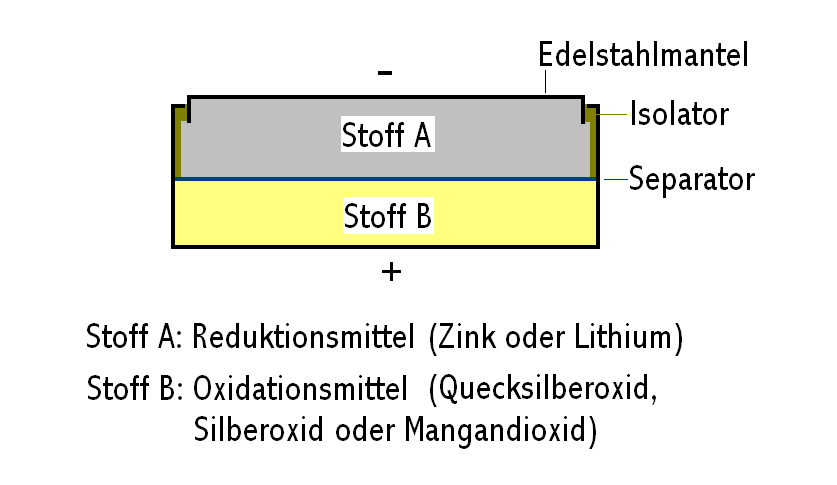
Stoff A ist bei der Quecksilber- bzw. Silberoxidbatterie Zink,
das oxidiert wird und Elektronen liefert.
Bei der Lithiumbatterie ist Stoff A Lithium, das unter Elektronenabgabe oxidiert wird.
Zn -> Zn2+ + 2 e-
Stoff B ist Quecksilberoxid bzw. Silberoxid, bei der
Lithiumbatterie Mangandioxid. Die Oxide werden jeweils unter Aufnahme von
Elektronen reduziert.
HgO + 2 e- + H2O -> Hg + 2 OH-
Ag2O + 2 e- + H2O -> 2 Ag + 2 OH-
Elektrolyte sind wässrige Kalilauge und im Fall der Lithiumbatterie ein nichtwässriger Elektrolyt (Propylencarbonat/1,2-Dimethoxyethan).
(zurück)
Es wird ein Stromkreis geschaltet, der aus einer käuflichen Batterie (z.B. Alkaline) und einem Widerstand als Verbraucher (10 Ohm) besteht. An der Batterie wird die Spannung über eine längere Zeit gemessen. Hierzu kann man die Messwerterfassung mit einem Computer durchführen, z.B. mit einem Messgerät, das eine Computerschnittstelle hat.
Beispiel:
| t / min | 0 | 97 | 227 | 346 | 492 | 622 | 742 | 861 | 981 | 1106 | 1246 | 1349 |
| U / V | 1,52 | 1,43 | 1,39 | 1,38 | 1,34 | 1,33 | 1,32 | 1,30 | 1,29 | 1,29 | 1,29 | 1,28 |
Bei einer Spannung von 1,28 V ist die Batterie praktisch unbrauchbar. Bei vielen Geräten muss die Batterie sogar früher ausgetauscht werden.
Die mittlere Spannung beträgt U = 1,35 V
Stromstärke: I = U / R I = 1,35 V / 10 Ohm = 0,135 A
Leistung: P = U * I P = 1,35 V * 0,135 A = 0,183 W
elektrische Energie: W = U * I * t W = P *
t
W = 0,183 W * 1349 min = 247 W* min = 4,1 W * h = 0,0041 kW * h
Über den gemessenen Zeitraum (22,5 Stunden) liefert die Batterie also eine Energie von 0,0041 kW * h.
Bei einem Preis für eine solche Batterie von z.B. 2 Euro würde der Energiepreis für eine kWh 488 Euro betragen. Zum Vergleich: Eine kWh aus dem Stromnetz kostet ca. 0,22 Euro.
(zurück)
Wasserstoffbrennstoffzelle: H2 / OH- // OH- / O2
H2 + 1/2 O2 -> H2O DHB (H2O) = -285 kJ / mol
In Wasserstoff-Brennstoffzellen läuft im Grunde die Knallgasreaktion ab, bei der Sauerstoff und Wasserstoff explosionsartig zu Wasser reagieren. Damit das Ganze sanft verläuft und die freiwerdende Energie in Form von Strom genutzt werden kann, finden die Reaktionen der beiden Reaktionspartner in der Brennstoffzelle in zwei räumlich getrennten Teilreaktionen statt. In der einen Halbzelle nimmt Sauerstoff an einer Elektrode (Plus-Pol) Elektronen auf (Reduktion), in der anderen (Minus-Pol) gibt Wasserstoff Elektronen ab (Oxidation). Die Zellen sind in technischen Anwendungen der Brennstoffzelle durch Polymerelektrolyt-Membranen verbunden.
Bei der Verbrennung von einem mol Wasserstoff wird eine Energie von 285 kJ frei.
Vergleich mit der elektrischen Energie:
Gemessen wird eine Spannung von etwa einem Volt. Es werden für die Bildung von einem mol Wasser zwei mol Elektronen umgesetzt. Die Ladung Q ist das Produkt aus Avogadrokonstante und Elementarladung unter Berücksichtigung der Anzahl der Elektronen.
Wel = U * I * t = U * Q = U * n * NA * qe
Wel = 1 V * 2 * 6,022 * 1023 1/mol * 1,6 * 10-19 C
Wel = -193 kJ/mol
Wirkungsgrad = -193 kJ/mol / -285 kJ/mol = 0,67
(zurück)
Modellversuch zum Korrosionsschutz
Stundenziel:
Die Schülerinnen und Schüler sollen ein Korrosionsschutzverfahren
erarbeiten, indem sie die Beobachtungen eines Experimentes (Vorgänge an einem
mit einem Zinkblech präparierten Eisennagel) in Gruppenarbeit deuten.
Versuchsdurchführung:
1.) Aus etwa 1g Agar-Agar (Gel-Bildner, dient zur Fixierung) und 100 ml
Wasser wird unter Erhitzen eine Lösung hergestellt. Anschließend werden 1
Spatel Natriumchlorid, eine Spatelspitze Kaliumhexacyanoferrat-III und einige
Tropfen Phenolphthalein-Lösung hinzugefügt.
2.) Die Lösung wird in eine Petrischale gegossen. Dann legt man folgende
Gegenstände hinein: einen unbehandelten Eisennagel und einen Eisennagel, der in
der Mitte mit Zinkblech umwickelt ist.
3.) Der Versuchsansatz wird einige Zeit stehen gelassen
(zurück)