Bestimmung der Molaren Masse mit Hilfe der Gefriertemperaturerniedrigung
1. Versuchsdurchführung:
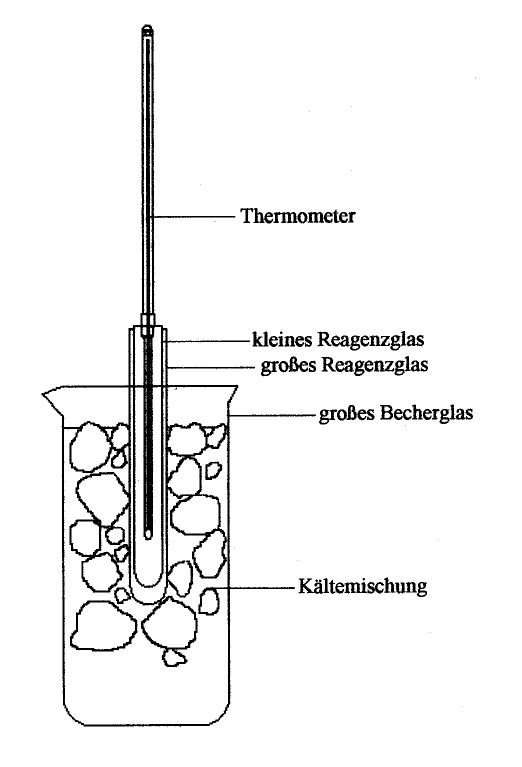
In 10 g Wasser wird 1 g Glucose gelöst. Die Lösung wird in ein Reagenzglas gegeben,
das von außen mit einer Kältemischung aus Eis und Kochsalz, die sich in einem Becherglas
befindet, gekühlt wird. Mit Hilfe eines Thermometers (mindestens 1/10
Grad-Einteilung) wird die Gefriertemperatur der Lösung bestimmt. Zu beachten ist dabei,
dass die Temperatur beim Erstarren der Lösung zunächst etwas unter die Gefriertemperatur
absinkt, dann wieder etwas ansteigt und bei der Gefriertemperatur ein bis zwei Minuten
konstant bleibt, bis sie erneut wieder absinkt.
Am Besten ermittelt man die Temperatur der Lösung in Abhängigkeit von der Zeit
(z.B. beginnend bei 8 °C) und stellt die Werte grafisch dar.
Zum Vergleich wird die Gefriertemperatur nach dem gleichen Verfahren für reines Wasser
(Lösungsmittel) bestimmt. |
 |
2. Auswertung:
Die Gefriertemperaturerniedrigung der Lösung gegenüber reines Wasser wird berechnet.
1 mol eines Nichtelektrolyten ergibt in 1 kg Wasser gelöst eine
Gefriertemperaturerniedrigung von 1,86 K (Gesetz von Raoult). Dies kann man zur Bestimmung
der molaren Masse ausnutzen.
Es gilt hierbei folgende Beziehung für die Gefriertemperaturerniedrigung T:
T = K * n(Stoff) / m(Lösungsmittel)
K = 1,86 K*kg/mol (für Wasser als Lösungsmittel)
Berechnen Sie die Stoffmenge der gelösten Glucose und die molare Masse von Glucose.
3. Beispiel:
Tabelle Gefriertemperatur in Abhängigkeit von der Zeit (Glucoselösung):
| s |
0 |
20 |
40 |
60 |
80 |
100 |
120 |
140 |
160 |
180 |
200 |
220 |
240 |
260 |
280 |
300 |
320 |
| °C |
8,0 |
6,0 |
4,0 |
2,9 |
2,0 |
0,9 |
0 |
-0,5 |
-1,6 |
-2,0 |
-2,3 |
-1,6 |
-1,4 |
-1,2 |
-1,1 |
-1,1 |
-1,1 |
Für Wasser wurde eine Gefriertemperatur von -0,1 °C und für die Glucoselösung eine
Gefriertemperatur von -1,1 °C gemessen.
n (Glucose) = T * m (Wasser) / K
n (Glucose) = 1 K * 0,01 kg / 1,86 K * kg * mol-1
n (Glucose) = 0,00538 mol
M (Glucose) = m (Glucose) / n (Glucose)
M (Glucose) = 1 g / 0,00538 mol
M (Glucose) = 186 g/mol
Literaturwert: M (Glucose) = 180 g/mol
Eine Fehlerquelle ist, dass Glucose in der Regel wasserhaltig ist. Man sollte sie daher
vor dem Versuch im Trockenschrank bei etwa 100 °C trocknen.
